
随着生活水平的不断提高,饮食结构的改变,痛风已由“帝王病”(king’s disease)转变为“病中之王”(king of the diseases)。之前,包括欧洲、日本、中国等都先后发布了痛风治疗指南,2012年10月,美国风湿病学会(American college of rheumatology,ACR)正式发布了“2012ACR痛风治疗指南”(以下简称“指南”)。与之前其他国家、组织发布的指南相比,该指南包含了许多新的内容,值得研究、思考。本文在介绍2012ACR痛风治疗指南同时,对其内容作一评析。
“指南”分为两个部分。第一部份主要针对“降尿酸治疗”和“慢性痛风石性痛风的治疗”;第二部分针对“镇痛治疗”、“抗炎治疗”和“痛风性关节炎发作的抗炎药物预防”。
流行病学
目前美国成年人痛风患病率为3.9%,全美有约830万痛风患者。痛风患者增多的原因主要与促发高尿酸血症的合并症:高血压、肥胖、代谢综合征、II型糖尿病,慢性肾功能不全(CKD)患病率增加,以及饮食习惯改变,噻嗪类利尿剂、袢利尿剂使用增多有关。
评析:中国等发展中国家经济处于上升期,生活水平的不断改善和饮食结构的改变是导致近年来痛风/高尿酸血症发病率不断上升的主要原因。美国等西方发达国家,经济水平发展到相对平稳阶段,饮食结构基本上已经处于“稳定”状态,引发高尿酸血症的合并疾病以及药物因素则可能是导致痛风患病率不断上升的主要因素。
患者宣教和合并症处理
对患者进行宣教,包括饮食指导,提倡良好的生活方式,告知患者治疗的目标,积极治疗可导致高尿酸血症的合并疾病是治疗的核心内容之一。
评析:对患者进行积极有效的宣教是慢性疾病治疗的重要环节。欧洲抗风湿联盟(EULAR)会议上流行病学调查数据显示:痛风患者在疾病认识上广泛存在误区,缺乏规范降尿酸治疗的知识,而且患者用药依从性较差。家庭医生及非风湿科专科医生亦缺乏规范治疗的概念。因此,“指南”特别强调“宣教”的重要性,同时提出积极控制可以导致高尿酸血症的合并疾病是预防、治疗痛风的重要环节,值得引起重视。
降尿酸治疗
黄嘌呤氧化酶抑制剂别嘌醇和非布司他(非布索坦,febuxostat)是首选的降尿酸药物。降尿酸治疗应使症状、体征得到有效的、持续的改善,尿酸水平至少应该降至 <6mg /dl,一般应<5mg/dl,或者说对所有痛风患者降尿酸目标是血尿酸<6mg/dl,但对于有痛风石的患者,应该降至5mg/dl以下。
别嘌醇的起始剂量不应超过100mg/d,中、重度慢性肾功能不全的患者应该从更小的剂量(50mg/d)开始,然后逐渐增加剂量,找到适合的维持剂量。维持剂量可以超过300mg/d,甚至在CKD患者中也可以超过此剂量。对于服用剂量大于300mg/d的患者,应该注意搔痒、皮疹和肝酶增高,可以尽早发现严重药疹。
对于特定的人群,如:韩国裔,同时有3级以上CKD;所有中国汉人、泰国裔,因为HLA-B*5801阳性率高,发生别嘌醇相关的严重过敏性药疹危险性增高,在使用别嘌醇前,应该进行HLA-B*5801快速PCR检测。
如果单一的黄嘌呤氧化酶抑制剂(xanthine oxidase inhibitor,XOI)在增加到适当剂量后仍不能达到治疗目标(达标),可以联合使用一个促进尿酸排泄药物(uricosuric)。这些药物包括美国市场可得的丙磺舒、非诺贝特(off-label使用)、氯沙坦(off-label使用),但不包括苯磺唑酮和苯溴马隆。
在痛风急性发作期,如果已经使用抗炎药物,可以开始降尿酸治疗。
评析:在“指南”中强调了达标治疗的理念,明确提出了降尿酸治疗的目标值,对于治疗效果的评判以及保证患者病情长期稳定具有非常重要的意义。对伴有痛风石的患者制定更为严格的治疗目标,有利于痛风石的吸收。
在降尿酸药物选择上,首选黄嘌呤氧化酶抑制剂别嘌醇和非布司他,而在中国广泛使用的苯溴马龙未被推荐。其主要原因为:美国曾经发现服用苯溴马龙后导致肝功能衰竭,因此该药被FDA禁止使用,目前美国市场已经没有苯溴马龙供应。另外一个原因是:美国人群中HLA-B*5801阳性率明显低于一些亚裔人群,在亚裔人群中易发生的别嘌醇相关的严重药疹并不多见,因此有条件将别嘌醇作为首选的药物。非布司他是近年上市的新型黄嘌呤氧化酶抑制剂,其降尿酸作用与别嘌醇相当或略优,研究表明该药物导致的药疹明显低于别嘌醇,因此有广阔的市场前景。但是目前该药在中国尚未上市,即便在美国、欧洲,该药价格依然非常昂贵,该药与别嘌醇同时被选为首选的降尿酸药物,显然只是出于临床疗效的考虑,并未考虑药物经济学因素。这一点,在“指南”中也坦承告知。在中国,由于别嘌醇引起的严重药疹发生率相对较高,苯溴马龙引起的严重肝功能损害相对少见,另外非布司他目前未在中国上市,在降尿酸药物的选择上,因该考虑与ACR指南的差异。
别嘌醇相关的严重药疹与HLA-B*5801密切相关已经得到肯定。在部份亚裔人群中,由于该基因的阳性率较高,因此一直成为亚裔痛风患者的用药顾虑。早在2008年,台湾地方行政部门就已经发布指令,在服用别嘌醇之前,必须进行该基因检测。但是在亚裔患者中,该检测并未广泛开展。此次,“指南”特别强调了HLA-B*5801检测的重要性。笔者的研究小组一年前成功研发的该基因快速PCR检测的方法,并且申报了发明专利,目前已经在向产品转化中,相信不远的将来,该项检测将成为可能。
别嘌醇的使用应该从小剂量开始,主要是出于以下考虑:小剂量开始,可以减少诱发痛风发作的可能;别嘌醇相关的严重药疹与药物剂量相关。2010年版中国痛风诊疗指南也提出应该从100mg/d剂量起始,但是在实际工作中,尤其在基层医院和非专科医生中,该点常常被忽视。
对于使用足量黄嘌呤氧化酶抑制剂后仍不能“达标”的患者,可以合并使用促进尿酸排泄的药物,在国内,该观点也较早被接收。但是合并哪种药物,什么时候开始合并用药仍值得注意。何为“足量”?,笔者认为应该是药物说明书所载的最大允许剂量,但是应该充分考虑最大剂量时可能出现的不良反应,对于肾功能不全的患者应更为谨慎。
非诺贝特、氯沙坦等药物原本并非用于降尿酸治疗,但是在使用中发现这几种药物有利于促进肾脏尿酸的排泌,因此高尿酸血症患者在选择降脂药、降压药时,应优先选择这些药物。但是在痛风患者中,不推荐单独采用这些药物来进行降尿酸治疗,而是可以与黄嘌呤氧化酶抑制剂合并使用,以提高降尿酸治疗效果。
国际上一些痛风治疗指南包括中国指南大多认为:降尿酸治疗均应在急性发作平息至少2周后方可开始,理由是急性痛风发作期采用降尿酸治疗可能会加重痛风的症状。“指南”首次提出,在有效抗炎药物“保护”下,降尿酸治疗并非禁忌。这一新观点值得在以后的临床实践中加以证实。
促尿酸排泄药物
如果采用单药治疗,丙磺舒是该类药物的首选;非诺贝特、氯沙坦具有治疗性降尿酸作用;有尿路结石病史者禁用促尿酸排泄药作为单药治疗;在使用促尿酸排泄药物前,应该测定尿尿酸水平,在治疗过程中也应该随访;在治疗中应保证足量水分摄入,碱化尿液,检测尿PH值。
评述:“指南”未将促尿酸药物作为首选,这符合从“源头”着手的思想。但是也有部分患者对黄嘌呤氧化酶抑制剂无效或者不能耐受者,仍有机会采用促尿酸排泄的药物。因为前述的原因,未推荐使用苯溴马龙。强调了促尿酸排泄药物使用中碱化尿液的重要性,因为药物使用过程中,有更多的尿酸从肾脏排出,碱化尿酸可增加尿酸的溶解量,可防止尿酸盐晶体在肾脏的沉积或者形成结石。尿尿酸的测定对于选择该类药物以及评价治疗效果具有重要的作用。正常人尿尿酸一般<600mg /d,尿尿酸水平不高者适合采用促尿酸排泄药物,但尿尿酸明显增高时,则不宜采用该类药物治疗。
尿酸酶和合并用药
对于严重痛风患者,如果对传统降尿酸治疗耐药或者不能耐受,可以使用尿酸酶(普瑞凯希,Pegloticase)治疗,但是用药周期多长,目前缺乏共识。在痛风患者中,为了预防心血管疾病危害而服用小剂量阿司匹林者,不要求停止服用。
评析:尿酸酶可以直接分解体内过多的尿酸,是痛风降尿酸治疗新的选择。该药为生物制剂,价格昂贵,其可能导致的过敏、耐药是生物制剂的共同特点,因此被推荐为“二线药物”。小剂量阿司匹林可以抑制肾小管对尿酸的排泌,被认为是引起高尿酸血症的重要诱因。之前,对于痛风患者合并服用阿司匹林者,医生往往建议患者服用其他的抗凝药物作为替代。“指南”提出,对于已经发生痛风的患者,阿司匹林所起的负面作用是可以忽略的,因此不必中止用药或换药,这一新观点对于以后的临床实践具有指导意义。
肾功能不全者降尿酸治疗
感谢邹教授的精彩解答:由邹教授翻译和评析的《2012年“美国风湿病学会痛风治疗指南”评析》已发布在风湿免疫频道的专家讲座栏目,欢迎大家点击查阅:
对于2-5级CKD或者终末期肾病患者,如果有过痛风发作,目前有高尿酸血症,就应该进行降尿酸治疗;对于肾功能不全的评估,Ccr比血肌酐更为重要;由于没有非布司他对4级或4级以上CKD患者用药安全性的资料,可以用丙磺舒作为一线药物;对于Ccr<50ml /min者,不推荐单独采用丙磺舒作为一线药物。
评析:肾功能不全一方面可以是长期痛风的并发症,另外各种肾病或者系统疾病引起的肾功能不全也可以导致继发性痛风发生。肾功能不全患者降尿酸治疗一直是棘手的问题。“指南”对于肾功能不全患者用药的提示显得非常重要。
血尿酸监测
血尿酸监测对于痛风治疗是必需的。在调整降尿酸药物过程中,每2-5周测定一次。在达标后(血尿酸<6mg /dl),也要每6个月测定一次。尿酸测定是调整药物剂量的依据,也有利于判断患者对治疗药物的依从性。
评析:痛风患者治疗过程中血尿酸的监测的重要性已经得到普遍认同。但是监测的时间间隔没有明确的规定。“指南”明确提出了血尿酸监测的周期,尤其是在降尿酸药物使用过程中每2-5周检测一次,与推荐的每2-5周进行一次药物剂量的调整相吻合。
非药物治疗
非药物治疗包括肥胖者减肥,尽量回复正常的体重指数(BMI),提倡健康的饮食,适当运动,戒烟,保证充足的水分摄入。饮食建议见表1。
表1. 痛风患者的饮食建
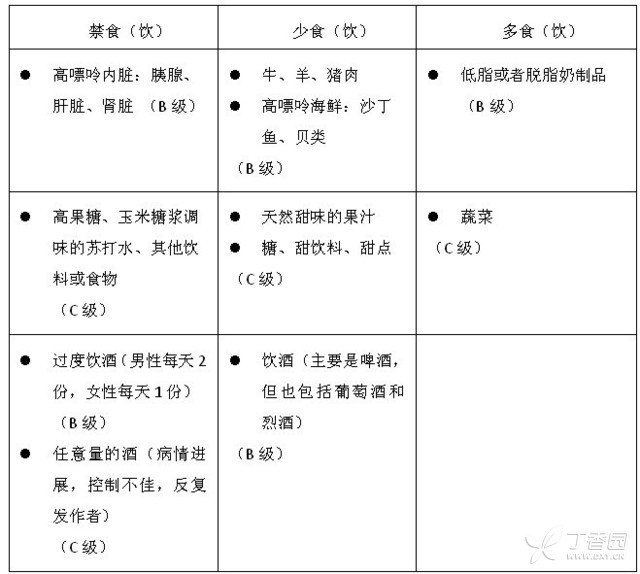
注:B级、C级指循征医学证据的级别
评析:痛风非药物治疗的重要性已被熟知。但既往认为酒类中红葡萄酒可以适当应用,甚至有研究认为红葡萄酒对痛风患者是有益的,但该“指南”将所有葡萄酒都列入“少食(饮)”的范围。对于乳制品,以往并未强调“低脂”、“脱脂”,但是在“指南”中被提出,应该是出于对肥胖等合并疾病的考虑。“指南”未对东方人饮食习惯中的豆制品、豆浆提出建议。
急性痛风的处理
急性痛风发病后24小时内,应该给与药物治疗;急性发作期,已经使用的降尿酸药可以继续使用;非甾体类抗炎药(NSAIDs)、糖皮质激素、秋水仙碱是急性关节炎发作的一线治疗药物。
秋水仙碱应该在痛风发作36小时内开始使用。如果使用的是1.2mg/片的制剂,开始负荷剂量为1.2mg,1小时后服用0.6mg。12小时后按照0.6mg,qd-bid服用;对于1mg/片的制剂,开始负荷剂量为1.0mg,1小时后服用0.5mg,12小时后最多可用到0.5mg,tid。
糖皮质激素推荐的剂量为泼尼松0.5mg/kg,连续用药5-10天停药。或者0.5mg/kg开始,用药2-5天,7-10天内逐渐减量,停药。
在NSAIDs选择上,而言是选用COX-2抑制剂,推荐选用依托考昔(etoricoxib),如使用塞来昔布,应该使用大剂量,且风险/受益尚不确定;对于严重以及顽固的病例,可以联合使用糖皮质激素+秋水仙碱,或者NSAIDs+秋水仙碱。
评述:“指南”推荐的一线药物在临床上已经被广泛接受。“指南”进一步明确了秋水仙碱的服用方法。长期以来,很多痛风指南(包括2010版中国指南)均建议首次剂量1.0mg,以后每1-2小时0.5mg,24小时总量不超过6mg。本指南推荐的剂量则明显减少,可以增加患者的耐受性,减少不良反应,而疗效并不受到影响。“指南”中强调前两次服药后,12小时开始规则用药,主要是基于研究发现,服药12小时后,秋水仙碱的血药浓度明显降低,因此12小时后即应开始每天两次或三次的规则服药。
在NSAIDs选择上,依托考昔已经被FDA批准具有急性痛风治疗的适应证,因此成为被推荐的特异性COX-2抑制剂。
值得强调的是在合并用药方面,没有推荐糖皮质激素与NSAIDs的联合,主要是考虑到这两种药物共同的消化道副作用,联合使用会增加消化性溃疡、出血的可能性,应该避免。
痛风的预防用药
口服秋水仙碱和小剂量NSAIDs是预防痛风发作的一线药物。在开始降尿酸药物治疗时,首选秋水仙碱0.5mg, qd或bid,或者服用小剂量萘普生250mg, bid,并合用质子泵抑制剂。上述药物无效时,可以采用小剂量糖皮质激素,泼尼松≦10mg/d。对于有痛风活动征象者,用药持续6个月。痛风活动征象包括:①体检发现痛风石;②近期急性痛风发作;③慢性痛风性关节炎和/或血尿酸水平未达标。或者对于降尿酸治疗患者,持续用药至血尿酸达标后3个月(无痛风石者)或6个月(有痛风石者)。
评述:痛风的预防包括一次急性发作后再次发作的预防,以前服用降尿酸药物过程中诱发的“二次痛风”的预防。尽管部分痛风患者在急性发作期,或者孤立的几次实验室检测中血尿酸可以处在正常水平,但是其病程中一定有高尿酸血症出现,“没有尿酸就没有痛风!”,因此降尿酸治疗对于大多数痛风患者来说都是适用的。因此痛风发作的预防实际上就是降尿酸治疗过程中痛风再次发作的预防。
以往临床上也都采用了上述预防药物,但是在疗程上均明显不足。之所以将糖皮质激素列入二线预防药物,主要是考虑到长期使用糖皮质激素可能带来的多种不良反应。
本文对2012年“美国风湿病学会痛风治疗指南”作了解读和评析。应该看到,医学发达国家在指南制定过程中有着严格的程序和规范,其科学性更高,参考价值更大,值得我们在制定本国指南时参考。在ACR指南中特别提到,由于缺乏随机对照研究的资料,“指南”未对单纯的高尿酸血症的治疗提出建议,这充分显示出“指南”制定过程中的客观和严谨。当然由于种族的差异、经济水平的不同,可供药物的区别,美国指南可能并不完全适合中国的国情,其合理性、科学性有待今后临床实践的检验。
参考文献:
1. 孟济明,邹和建. 风湿病学发展的点滴思考(述评). 内科理论与实践,2011,6(5):329-330.
2. 中华医学会风湿病学分会. 原发性痛风诊断和治疗指南. 中华风湿病学杂志,2011,15(6):410-413.
3. Dinesh Khanna, Jhon D. Fitzgerald, Puja P. Khanna, etal. 2012 American college of rheumatology guidelines for management of gout. Part 1: Systemic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia. Arthritis Care & research. 2012,64(10):1431-1446.
4. Dinesh Khanna, Puja P. Khanna, John D. Fitzgerald, et al. 2012 American college of rheumatology guidelines for management of gout. Part 2: Therapy and anti-inflammatory prophylaxis of acute gouty arthritis. Arthritis Care & Research. 2012,64(10):1447-1461.
资助基金:
本文得到“上海市优秀学术带头人计划:尿酸代谢异常的基础研究及痛风发病机制、干预策略研究(课题编号:11XD1401100)”及“上海市科委基础研究重大项目:痛风和高尿酸血症发生机制研究与干预策略(11DJ1400100)”资助。