摘要
11月CDE共承办药品注册申请762件
48个一致性评价品种获CDE承办,其中9个品种为首家申报
有6个中药新药获CDE承办
仿制申请中有5个品种为首家企业提交仿制申报
2个1类新药获批,8个新分类仿制药获批
68个品种获临床试验默示许可
CDE总体承办情况
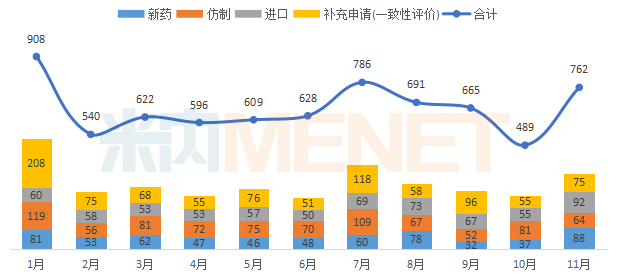
据MED中国药品审评数据库2.0统计,2019年11月CDE共承办药品注册申请762个。除仿制申请外,新药申请、进口申请和一致性评价申请比上月均有所上升。
2019年1-11月CDE承办药品注册申请情况(按受理号计)
一致性评价补充申请承办情况
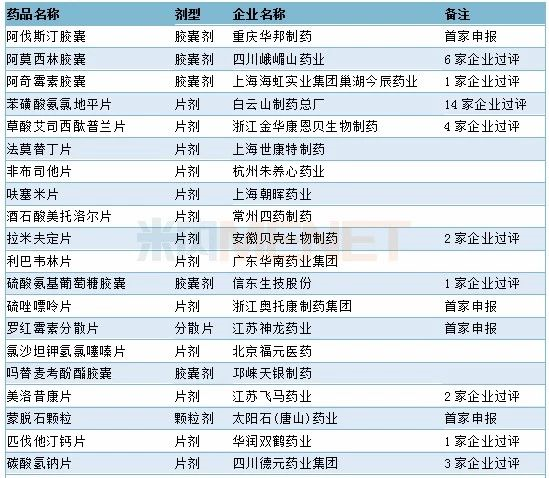
11月有48个一致性评价品种获CDE承办(10月为42个),其中口服制剂有28个,注射剂有20个,有9个品种首家企业开始一致性评价。详细情况请见下表:
2019年11月CDE补充申请(一致性评价)口服制剂品种承办情况

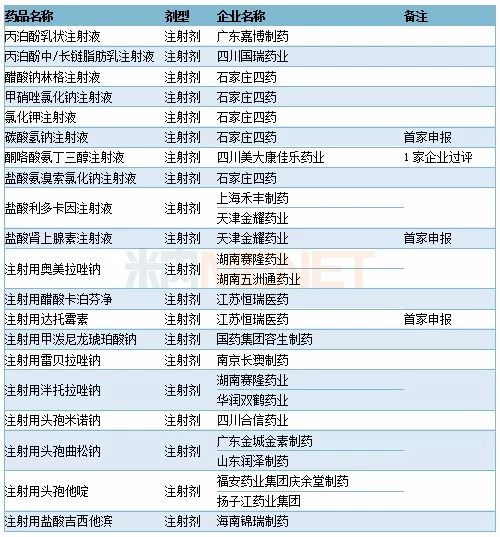
2019年11月CDE补充申请(一致性评价)注射剂品种承办情况
新药申请承办情况
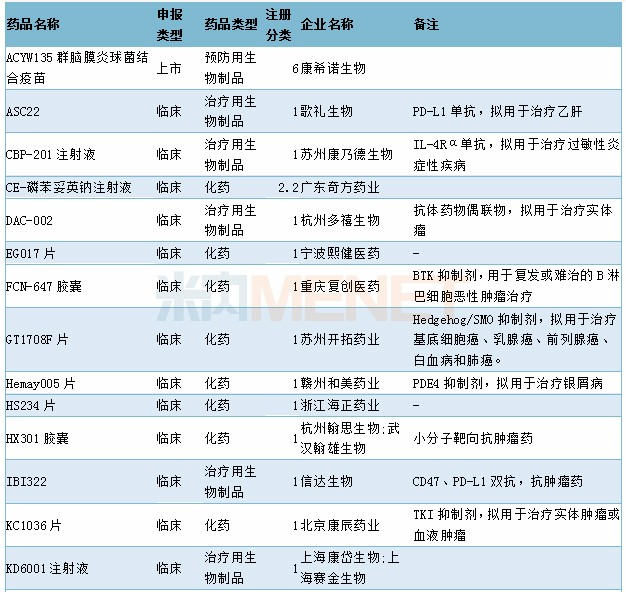
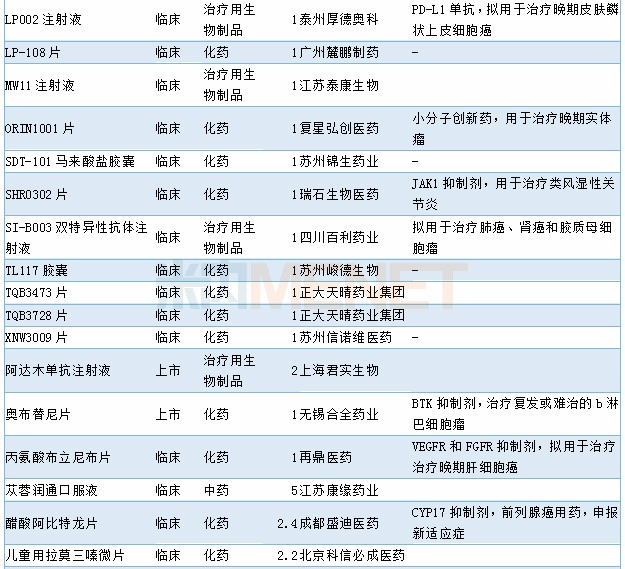
11月有54个药品的新药申请获CDE承办,其中属于1类新药的药物有37个,2类改良型新药(2.2类、2.4类)5个,此外还有6个中药新药。详细情况请见下表:
2019年11月国内新药申请承办情况
仿制申请承办情况
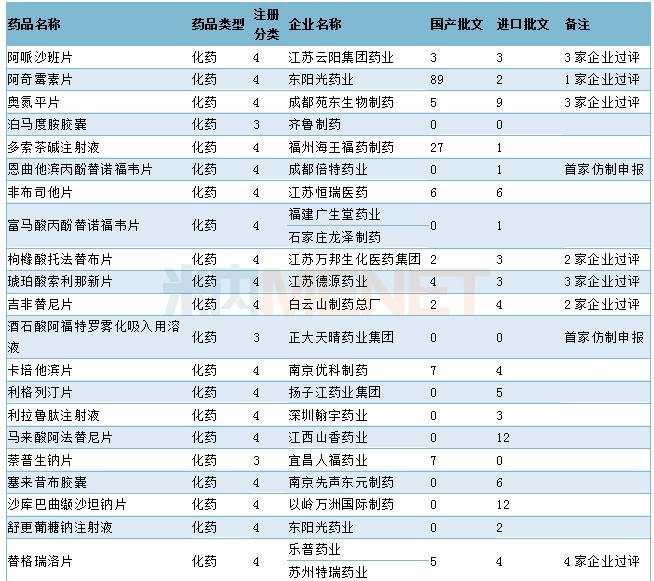
11月CDE共承办45个品种的仿制申请,其中按3类仿制申请的品种有9个,按4类仿制申请的品种有36个,13个品种目前已有企业通过一致性评价,5个品种为首家企业提交仿制申报。
2019年11月国产仿制申请承办情况
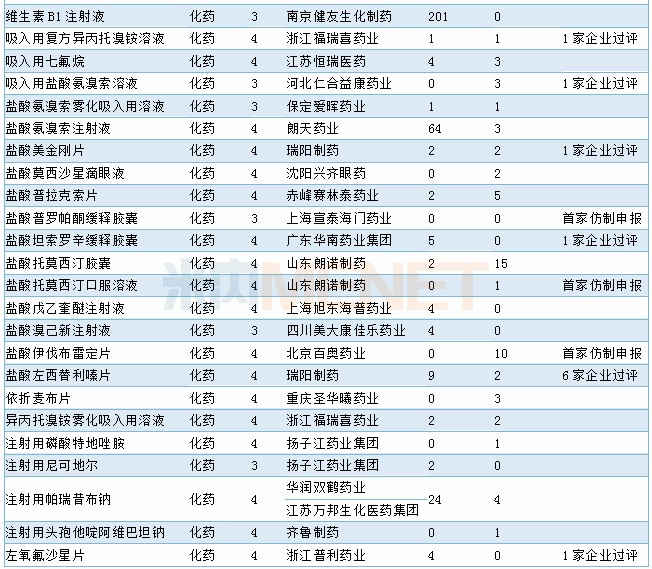
进口申请承办情况
11月CDE共承办46个药物的进口申请,其中1类新药有7个,2.4类改良型新药有8个,5.1类进口原研药12个,5.2类进口仿制药6个。具体情况请见下表:
2019年11月进口申请承办情况
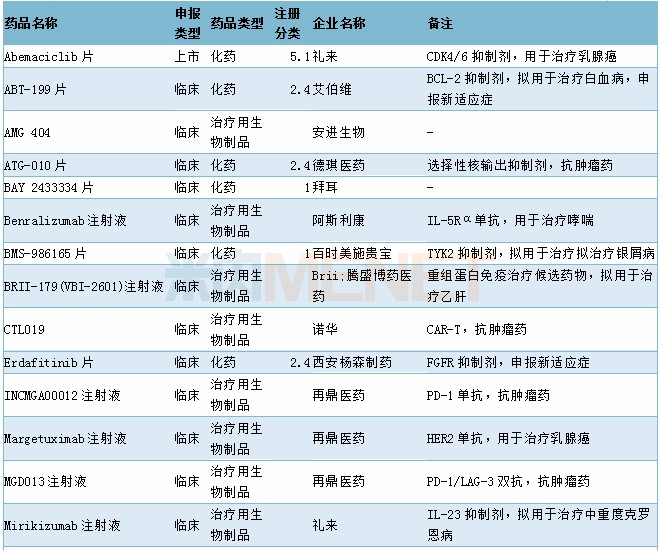
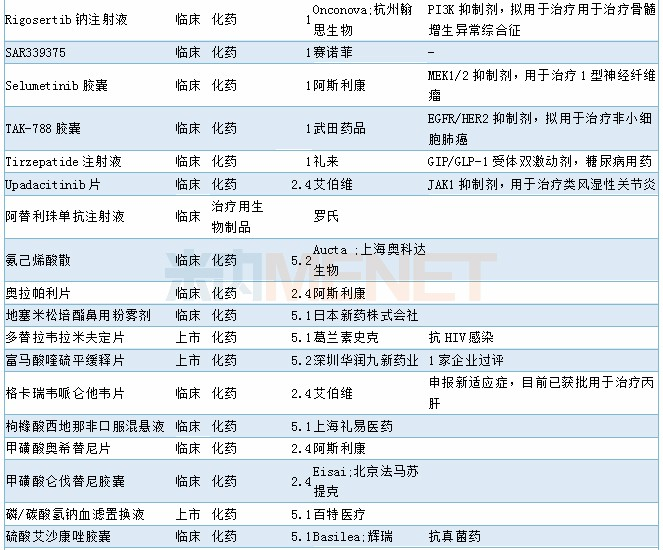
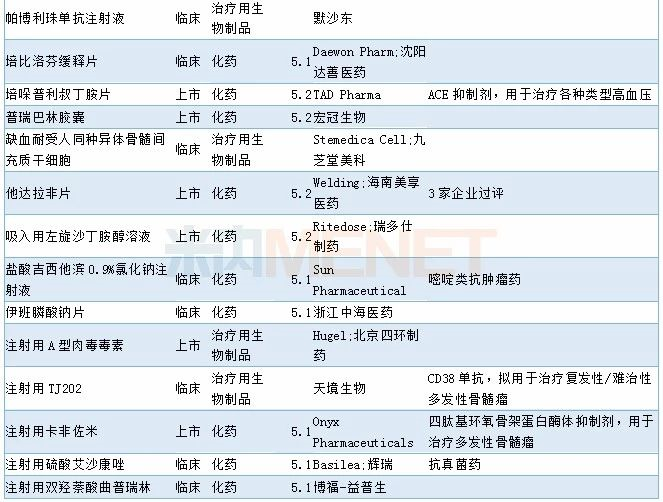
审批情况
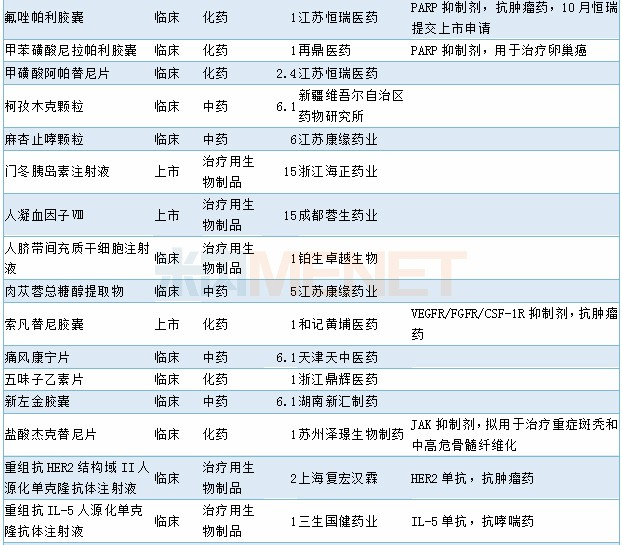
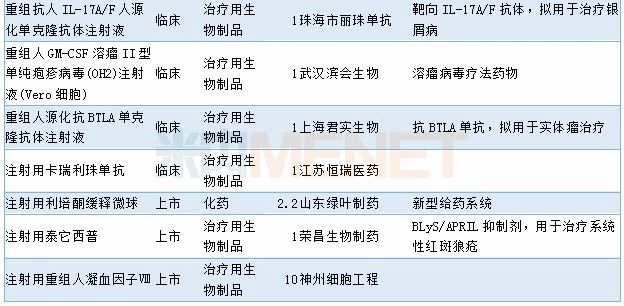
11月有2个1类新药以及1个2类生物制品新药获批,7个4类仿制药以及1个3类仿制药获批,2个5.1类进口原研药获批进口,阿斯利康奥拉帕利片新适应症获批上市,68个品种(涉及97个受理号)获临床试验默示许可。具体情况请见下表:
2019年11月部分品种获批情况
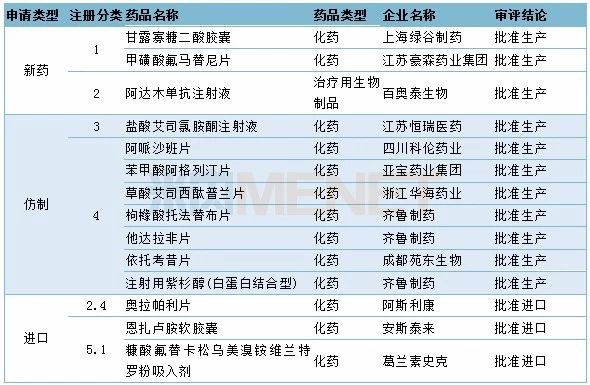
(说明:获批时间据企业公告或相关报道统计)
2019年11月临床试验默示许可药品
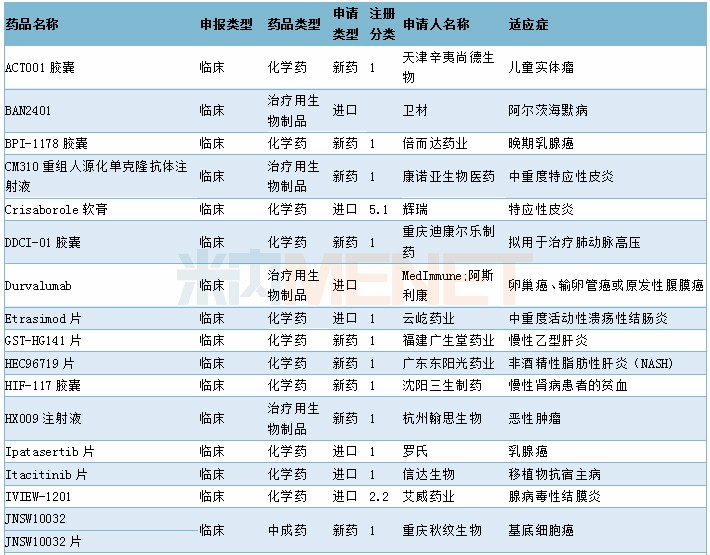
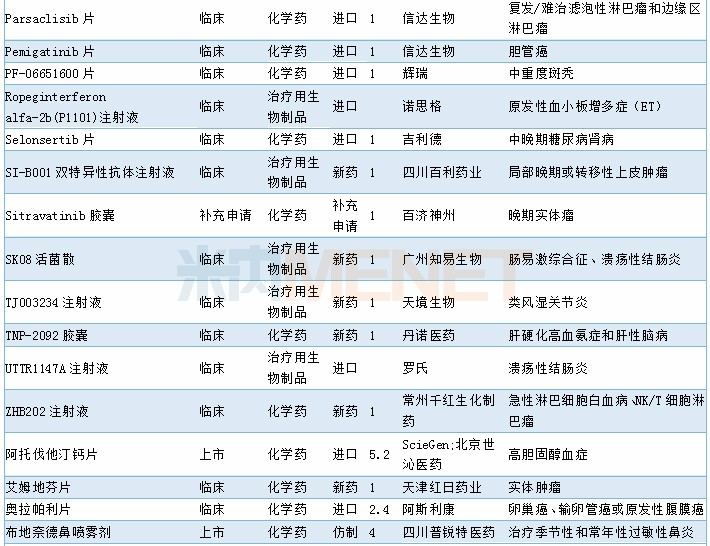
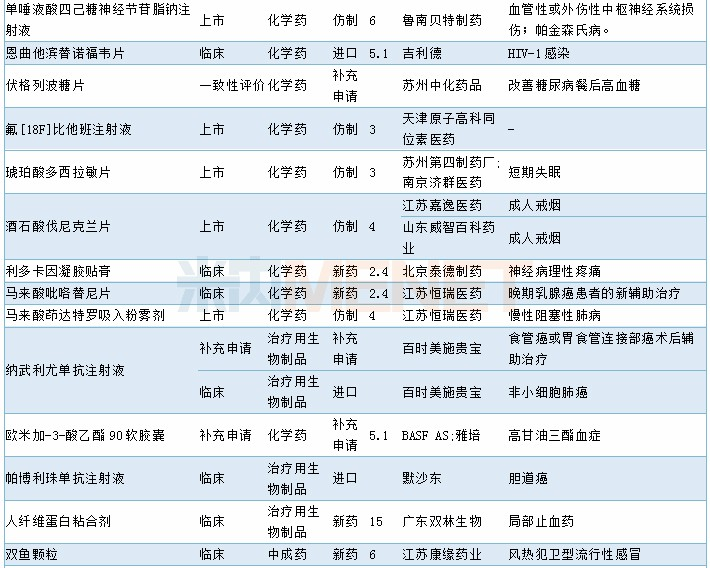
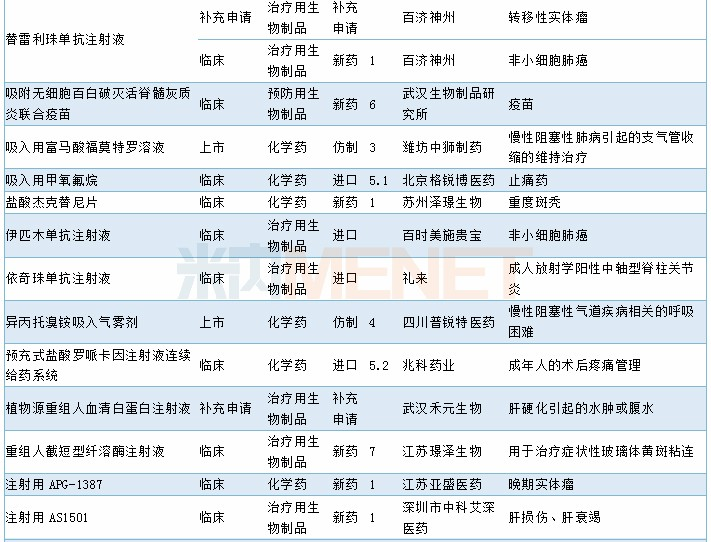
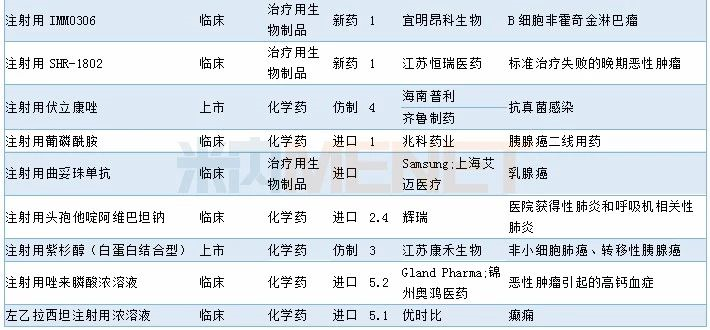 数据来源:米内网MED药品审评数据库2.0、CDE;相关统计截至2019年12月2日,按药品名称统计。
数据来源:米内网MED药品审评数据库2.0、CDE;相关统计截至2019年12月2日,按药品名称统计。